Articolo tratto da Fondazione Telethon
Grazie al finanziamento dell’associazione “Una vita rara AHDS-MCT8 Onlus” attraverso il bando “Seed Grant” Ilaria Decimo dell’Università di Verona potrà portare avanti la ricerca sulla malattia.
«Il vostro nome dice che voi sapete guardare il positivo: che ogni vita umana è unica, e che se la malattia è rara o rarissima, prima ancora è la vita a esserlo»: sono le parole che il 30 aprile 2018 Papa Francesco ha regalato a una “Una vita rara AHDS-MCT8 Onlus”, associazione di pazienti fondata da Giorgio e Rosita per il figlio Davide e gli altri ragazzi che come lui sono nati con una rarissima sindrome, quella di Allan Herndon Dudley, una rara malattia dello sviluppo del cervello che compromette lo sviluppo fin dalla fase prenatale e provoca disabilità intellettiva, epilessia e disturbi del movimento.
«A cinque anni dalla scoperta della malattia di nostro figlio, che oggi ha 17 anni, abbiamo voluto dare una spinta importante alla ricerca scientifica» raccontano Giorgio e Rosita. «In questi mesi di grande incertezza dovuta a Covid-19, ancora una volta abbiamo sperimentato sulla nostra pelle un senso di impotente fragilità, amplificata dalla rarità della malattia. Nel contempo siamo diventati ancora più consapevoli dell’urgenza di sostenere la ricerca per migliorare le condizioni di vita dei nostri ragazzi. Con la nostra associazione abbiamo partecipato all’iniziativa “Seed Grant” di Fondazione Telethon, certi che il progetto di ricerca sulla malattia di nostro figlio individuato dai revisori seguirà gli standard richiesti dalla comunità scientifica internazionale. In un presente incerto, ma carico di speranza per il futuro, la parola che meglio descrive il nostro stato d’animo è gratitudine: verso gli amici che hanno reso possibile l’attività della nostra piccola associazione, verso i donatori che ci hanno permesso di raccogliere fondi da destinare alla ricerca scientifica, verso Fondazione Telethon che ha messo in campo le sue competenze e naturalmente verso i ricercatori che hanno deciso di aiutarci in questo nostro cammino di speranza».
La sindrome di Allan Herndon Dudley è dovuta a un difetto nella proteina MCT8, che ha un ruolo chiave nello sviluppo del sistema nervoso fin dalla vita intrauterina: trasporta infatti all’interno delle cellule nervose un ormone fondamentale per il normale sviluppo del cervello, la triiodotironina o T3. Quando il trasportatore è difettoso, T3 non arriva in quantità adeguate al cervello che si sta formando e questo si traduce in difetti neurologici e cognitivi fin dalle prime fasi di vita. Inoltre, l’ormone tende ad accumularsi nel sangue e a danneggiare altri organi, come per esempio i muscoli, che progressivamente si indeboliscono e perdono di tono. Il progetto di ricerca che sarà finanziato grazie ai fondi raccolti dall’associazione è quello di Ilaria Decimo dell’Università di Verona, che proverà ad affrontare questa patologia da un punto di vista nuovo.
«Tutti gli approcci terapeutici tentati ad oggi si sono basati sulla somministrazione di ormoni tiroidei o di loro analoghi che non richiedano MCT8 per raggiungere il cervello, ma non hanno dato ancora risultati significativi – spiega la ricercatrice. Noi vogliamo provare a bypassare il problema agendo invece sui mitocondri, le centrali energetiche delle nostre cellule. Per un normale sviluppo del cervello, infatti, è necessario che i mitocondri funzionino correttamente: la nostra ipotesi è che in assenza di T3 i mitocondri non riescano a lavorare a pieno regime come richiesto nelle prime fasi cruciali dello sviluppo e che possano essere quindi un bersaglio terapeutico interessante per contrastare questa malattia, grazie a molecole note per essere in grado di potenziarne la funzione, come per esempio la nicotinamide riboside».
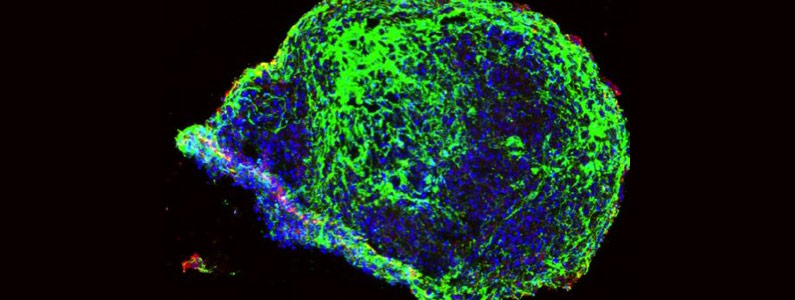
Per verificare la loro ipotesi, Ilaria Decimo e il suo gruppo si avvarranno anche di uno degli strumenti emergenti più innovativi degli ultimi anni: gli organoidi, ovvero modelli tridimensionali di organi o di parti di essi ottenuti interamente in provetta a partire da cellule staminali adeguatamente “istruite”. «Mettendo in coltura le cellule staminali insieme a un cocktail di specifiche sostanze – continua Decimo – possiamo indurle a differenziarsi in neuroni come avviene nelle prime fasi della vita embrionale. Man mano che si differenziano, i neuroni iniziano ad auto-aggregarsi, stratificarsi e a creare connessioni funzionali fra loro, le cosiddette sinapsi che sono la base della comunicazione nervosa. Per quanto siamo ancora lontani dal poter creare un vero e proprio “cervello in provetta”, questi modelli sono molto utili perché rispetto alle cellule in coltura sono tridimensionali, quindi ci danno una rappresentazione più fedele della realtà su cui testare le nostre ipotesi. In particolare, svilupperemo organoidi cerebrali in assenza di T3 per capire gli effetti dannosi e successivamente testare molecole in grado di evitare il danno».